¿Cuáles son los componentes fundamentales de la materia?
| Característica | Prótones | Neutrones | Electrones |
|---|---|---|---|
| Ubicación | Núcleo del átomo | Núcleo del átomo | Orbitan alrededor del núcleo |
| Carga | Positiva (+) | Neutral (0) | Negativa (-) |
| Masa | 1.673 x 10^-27 kg | Aproximadamente igual a la del protón | Mucho menor que protón y neutrón |
| Número Atómico e Identidad Química | Define el número atómico y la identidad química de los elementos | No influye directamente | No define |
| Papel en Enlaces Químicos | Indirecto a través de la estructura electrónica | Indirecto a través de la masa y estabilidad del átomo | Esencial en la formación de enlaces |
| Contribución a la Masa Atómica | Directa, junto con los neutrones | Directa, junto con los protones | Negligible |
| Implicaciones en Isótopos | No afecta, número constante en isótopos | Varía el número entre isótopos, afectando la masa | No involucrado directamente |
| Formación de Iones | Gana/pierde electrones para formar iones | No involucrado directamente | Pérdida o ganancia de electrones forma iones |
Esta tabla compara las propiedades fundamentales de los prótones, neutrones y electrones, los bloques constructores de la materia. Se detalla desde su localización dentro del átomo hasta su implicación en características críticas como el número atómico, la masa, y su papel en los enlaces químicos y formación de iones. Este conocimiento es clave para entender la estructura y estabilidad de los átomos, esencial en el campo de la química y la física.
Los protones, neutrones y electrones son los componentes fundamentales de la materia. Los protones tienen una carga positiva y se encuentran en el núcleo, mientras que los neutrones no tienen carga y también residen en el núcleo. Los electrones, que tienen una carga negativa, orbitan alrededor del núcleo en niveles de energía definidos. Estos componentes desempeñan roles distintos en la definición de las características de los átomos. Comprender estos componentes es esencial para comprender el comportamiento de los átomos y la formación de iones.
- Aspectos clave
- Comprendiendo la Estructura Atómica
- Protones: La Carga Positiva
- Neutrones: La Partícula Neutra
- Electrones: Los Orbitadores Negativos
- Masa atómica y su importancia
- Descubrimientos históricos
-
Preguntas Frecuentes
- Las partículas subatómicas que componen un átomo son los protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo del átomo, mientras que los electrones orbitan alrededor del núcleo en niveles de energía
- ¿Por qué la cantidad de protones en un átomo determina su número atómico?
- ¿Qué es un isótopo y cómo se relaciona con la cantidad de neutrones en un átomo?
- ¿Cómo influye la cantidad de electrones en la carga eléctrica de un átomo y qué son los iones?
- ¿Cuál es la diferencia en la masa entre un protón, un neutrón y un electrón, y por qué es relevante en la masa atómica de un elemento?
- Conclusión
Aspectos clave
- Los protones, neutrones y electrones son los componentes fundamentales de la materia.
- Los protones tienen una carga positiva, los neutrones son neutros y los electrones tienen una carga negativa.
- Estas partículas subatómicas son cruciales para definir las características y el comportamiento de los átomos.
- Los protones y neutrones residen en el núcleo, mientras que los electrones orbitan a su alrededor.
- Comprender estos componentes es esencial para comprender la estructura de toda la materia.
Comprendiendo la Estructura Atómica
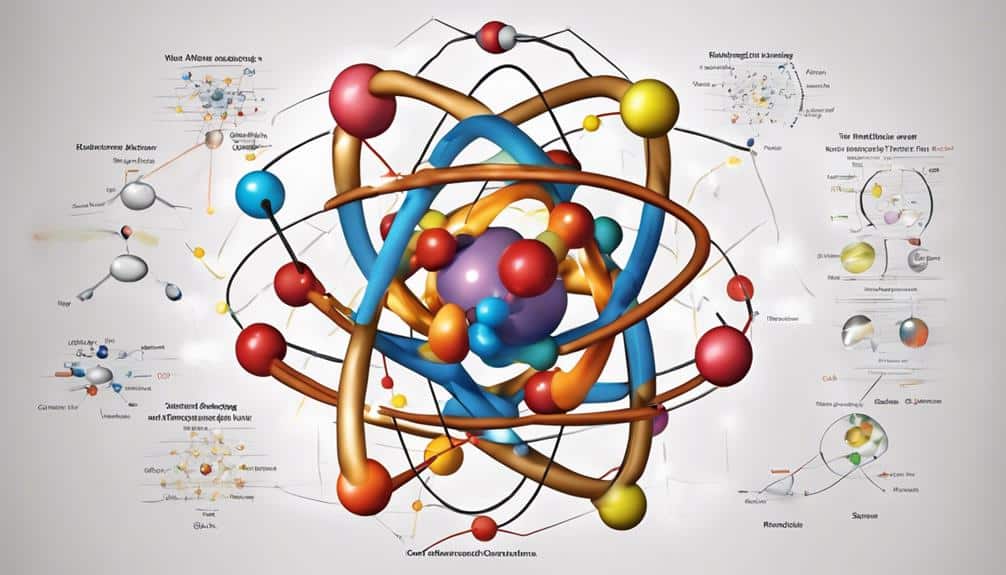
Entender la estructura atómica implica reconocer los componentes fundamentales que conforman un átomo, a saber, protones, neutrones y electrones.
Los protones llevan una carga positiva y residen en el núcleo, mientras que los neutrones, con una carga neutral, también habitan en el núcleo.
Los electrones, con carga negativa, orbitan alrededor del núcleo en niveles de energía definidos, contribuyendo a las propiedades generales de cada elemento.
Componentes de un átomo
La intrincada composición de un átomo comprende partículas de protones, neutrones y electrones, cada una desempeñando un papel distinto en la definición de las características y propiedades de los elementos. Los protones y neutrones se encuentran en el núcleo atómico, mientras que los electrones se encuentran en las capas exteriores del átomo.
Lee También
Un átomo tiene un número igual de electrones y protones, con el conteo de neutrones variando. Los protones llevan una carga positiva, los neutrones son neutrales y los electrones tienen una carga negativa. La masa de un protón es de 1.673 x 10^-27 kg, equivalente a 1 unidad de masa atómica (uma).
Ernest Rutherford descubrió el protón en 1911. Los protones están compuestos por tres partículas elementales llamadas quarks: 2 quarks up y 1 quark down. El cálculo del número de protones en un átomo se basa en su número atómico, que representa su posición en la tabla periódica.
Roles de los protones, neutrones, electrones
Dentro de la estructura intrincada de un átomo, los protones, neutrones y electrones desempeñan roles vitales en la determinación de las características y propiedades de los elementos. Estas partículas subatómicas son esenciales para entender la estructura atómica:
- Protones:
- Definición: Partículas subatómicas con carga positiva.
- Símbolo: p+
- Ubicación en el átomo: Núcleo.
- Masa: 1.673 x 10^-27 kg.
- Neutrones:
- Definición: Partículas subatómicas sin carga.
- Símbolo: n0
- Ubicación en el átomo: Núcleo.
- Masa: 1.675 x 10^-27 kg.
- Electrones:
- Definición: Partículas subatómicas con carga negativa.
- Símbolo: e-
- Ubicación en el átomo: Periferia de los orbitales.
- Masa: 9.109 x 10^-31 kg.
Protones: La Carga Positiva
El número atómico, definido por la cantidad de protones en un átomo, juega un papel significativo en la determinación de su identidad química y propiedades.
Los protones contribuyen con partículas cargadas positivamente al núcleo atómico, equilibrando los electrones cargados negativamente en el átomo.
Comprender la importancia de los protones en la definición de la estructura atómica es fundamental para comprender el comportamiento de los elementos en reacciones químicas.

Definiendo el Número Atómico
Los protones, como las partículas subatómicas cargadas positivamente que se encuentran dentro del núcleo de un átomo, desempeñan un papel esencial en la definición del número atómico de un elemento. Al discutir la composición atómica de un átomo, es vital comprender el papel de los protones.
Aquí hay algunos puntos clave para tener en cuenta sobre los protones y su importancia en la determinación del número atómico:
- Definición: Los protones son partículas subatómicas con carga positiva.
- Ubicación: Los protones se encuentran en el núcleo de un átomo.
- Carga: Los protones poseen una carga positiva de +1.
- Cálculo: El número de protones en un átomo es igual a su número atómico, que es el número de posición en la tabla periódica. Por ejemplo, el oro (Au) con un número atómico de 79 contiene 79 protones.
Impacto en la Identidad Química
La carga positiva que llevan los protones juega un papel fundamental en definir la identidad química de un elemento. Los protones, junto con los neutrones, se encuentran en el núcleo atómico, mientras que los electrones se encuentran en la periferia del átomo.
Las propiedades químicas de un átomo están determinadas principalmente por el número de protones que contiene, lo cual establece su número atómico. Los neutrones, por otro lado, contribuyen a la masa del átomo, con los isótopos diferenciándose en los números de neutrones.
Los electrones, que residen en la nube electrónica, influyen en la carga de un átomo al ganar o perder electrones para formar iones. Comprender la interacción entre protones, neutrones y electrones es esencial para comprender el comportamiento químico e identidad de los elementos.
Neutrones: La Partícula Neutra

Los neutrones juegan un papel esencial en la formación de isótopos al influir en la masa atómica de un elemento. Comprender la relación entre los neutrones y protones dentro del núcleo es vital para comprender la estabilidad y el comportamiento de las diferentes configuraciones atómicas.
Lee También
Su presencia o ausencia puede tener un gran impacto en las propiedades y reactividad de un átomo.
Papel en la formación de isótopos
Al considerar la formación de isótopos, la partícula esencial juega un papel significativo en la determinación de las características generales de un átomo. Los neutrones, las partículas vitales que se encuentran junto a los protones en el núcleo atómico, son fundamentales en la creación de isótopos. Aquí está cómo contribuyen a la formación de isótopos:
- Relación Neutrón-Protón: El equilibrio entre neutrones y protones en el núcleo afecta la estabilidad.
- Definición de Isótopos: Los átomos con el mismo número de protones pero diferente cantidad de neutrones se conocen como isótopos.
- Estabilidad Isotópica: Los neutrones proporcionan masa adicional sin agregar carga, lo que influye en la estabilidad de un isótopo.
- Variantes Isotópicas: Diferentes isótopos de un elemento exhiben propiedades físicas y químicas variables debido a las diferencias en neutrones.
Influencia en la Masa Atómica
En el contexto de la estructura atómica y la formación de isótopos, la presencia de neutrones, al ser partículas eléctricamente neutras dentro del núcleo de un átomo, influye significativamente en la determinación de la masa atómica de un elemento.
Los neutrones, junto con los protones, constituyen la mayor parte de la masa de un átomo, ya que los electrones contribuyen mínimamente debido a su masa despreciable. La suma de protones y neutrones en el núcleo de un átomo determina su masa atómica, siendo que cada neutrón y protón tienen una masa de aproximadamente 1 unidad de masa atómica (uma).
Los isótopos, al variar en el número de neutrones manteniendo el mismo número de protones, muestran lo esencial que son los neutrones para definir las diferencias en la masa atómica dentro de los elementos. Comprender la interacción entre protones, neutrones y electrones es fundamental para comprender las características y comportamiento generales de un elemento.
Electrones: Los Orbitadores Negativos
Los electrones desempeñan un papel fundamental en la formación de enlaces químicos y la creación de iones. A través de la transferencia o compartición de electrones, los átomos logran estabilidad y forman compuestos con propiedades únicas.
Lee También
Comprender el comportamiento de los electrones es esencial para comprender la reactividad y las características de diferentes elementos.
Esencial para los Enlaces Químicos
¿Qué papel fundamental desempeñan los orbitales con carga negativa, conocidos como electrones, en la formación de enlaces químicos entre átomos?
- Electrones de Valencia: Los electrones en la capa más externa determinan la reactividad de un átomo.
- Formación de Enlaces: Los electrones se comparten, ganan o pierden para crear enlaces químicos.
- Configuración Electrónica: Dicta la estabilidad de un átomo y su capacidad para formar enlaces.
- Enlace Iónico: Implica la transferencia de electrones entre átomos para lograr estabilidad.
Los electrones, con su carga significativa, son vitales para establecer las conexiones entre átomos. Su comportamiento rige el tipo de enlace formado, ya sea iónico, covalente o metálico, influyendo en las propiedades de las sustancias y facilitando la creación de compuestos diversos.
Formación de Iones
Los orbitales con carga negativa, conocidos como electrones, son fundamentales en la formación de enlaces químicos entre átomos, influenciando la reactividad y estabilidad a través de su participación en el intercambio de electrones, ganancia o pérdida. La tabla a continuación proporciona una comparación entre protones, neutrones y electrones en cuanto a carga, símbolo y ubicación dentro del átomo.
| Característica | Protón | Neutrón | Electrón |
|---|---|---|---|
| Carga | +1 | 0 | -1 |
| Símbolo | p+ | n0 | e- |
| Ubicación | Núcleo | Núcleo | Orbitales |
Comprender los roles y posiciones de estas partículas subatómicas es fundamental para comprender el comportamiento de los átomos y la formación de iones.
Masa atómica y su importancia
La masa atómica juega un papel fundamental en la determinación de las características generales de un átomo. Representa la masa total de un átomo, que está principalmente influenciada por la masa combinada de sus protones, neutrones y electrones.
Lee También
Comprender cómo se calcula la masa atómica y su importancia puede proporcionar valiosas ideas sobre el comportamiento y las propiedades de los diferentes elementos.
Calculando la Masa Atómica
Con precisión e importancia, el cálculo de la masa atómica juega un papel fundamental en la comprensión de la composición de los elementos. Al determinar la masa atómica de un elemento, considera lo siguiente:
- Protones y Neutrones: Los protones y neutrones se encuentran en el núcleo y representan la mayor parte de la masa de un átomo.
- Electrones: Si bien los electrones son esenciales para las reacciones químicas, su masa es insignificante al calcular la masa atómica.
- Isótopos: Los elementos pueden tener varios isótopos con diferentes números de neutrones, lo que afecta su masa atómica.
- Cálculo de Neutrones: Los neutrones se pueden calcular restando el número atómico (número de protones) de la masa atómica de un elemento.
Comprender estos componentes es vital para comprender las complejidades de la estructura y composición atómica.
Impacto Mínimo de Electrones
En el complejo ámbito de la estructura y composición atómica, la masa de los electrones juega un papel mínimo pero tiene una considerable importancia en la determinación de la masa atómica global de un elemento. Mientras que los protones y neutrones contribuyen sustancialmente a la masa de un átomo, los electrones tienen una masa insignificante en comparación con estas partículas.
Los electrones, ubicados en la nube electrónica que rodea al núcleo, tienen una masa aproximadamente 2000 veces menor que la de los protones y neutrones. Esta masa minúscula de los electrones es la razón por la que su impacto en el cálculo de la masa atómica es insignificante.
En consecuencia, al calcular la masa atómica de un elemento, a menudo se desestima la contribución de los electrones, centrándose principalmente en la masa combinada de protones y neutrones dentro del núcleo.
Descubrimientos históricos
Los descubrimientos históricos sobre los componentes fundamentales de la materia son esenciales para entender los bloques de construcción del universo.
Desde la identificación de los electrones por J.J. Thomson en 1897, hasta la revelación de los protones por Ernest Rutherford en 1911, y el descubrimiento de los neutrones por James Chadwick en 1931, estos hitos sentaron las bases para la teoría atómica moderna.
Estos hallazgos revolucionarios han transformado nuestra comprensión de la estructura atómica y de las interacciones entre partículas subatómicas.
Descubrimiento de los electrones
El descubrimiento revolucionario de J.J. Thomson de los electrones en 1897 cambió la comprensión de la estructura atómica y allanó el camino para futuros avances en el campo de la física.
- Experimento de Rayos Catódicos: Thomson observó los rayos catódicos y determinó que estaban formados por partículas cargadas negativamente.
- Modelo del Pudin de Ciruela: Propuso el Modelo del Pudin de Ciruela del átomo, donde los electrones estaban incrustados en una esfera cargada positivamente.
- Propiedades de los Electrones: Thomson identificó a los electrones como partículas con una masa mucho menor en comparación con protones y neutrones.
- Carga de los Electrones: Concluyó que los electrones llevan una carga negativa unitaria basándose en evidencia experimental.
Identificación de protones
El descubrimiento revolucionario de Thomson de los electrones en 1897 allanó el camino para una comprensión más profunda de la estructura atómica, lo que llevó a más descubrimientos históricos en el ámbito de las partículas subatómicas, incluida la identificación de los protones. Los protones son partículas cargadas positivamente que se encuentran en el núcleo atómico. A continuación se muestra una tabla comparativa entre protones, neutrones y electrones para ilustrar sus características clave:
| Propiedad | Protón | Neutrón | Electrón |
|---|---|---|---|
| Carga | Positiva (+1) | Neutra (0) | Negativa (-1) |
| Símbolo | p+ | n0 | e- |
| Ubicación | Núcleo | Núcleo | Periferia de los orbitales |
| Masa (kg) | 1.673 x 10^-27 | 1.675 x 10^-27 | 9.109 x 10^-31 |
Comprender las distinciones entre estas partículas subatómicas es esencial para comprender los componentes fundamentales de la materia.
Revelando Neutrones
Explorar las revelaciones históricas en torno al descubrimiento de los neutrones ofrece una visión más profunda del intrincado dominio de las partículas subatómicas. Los neutrones desempeñan un papel importante en la estructura de un átomo, contribuyendo en gran medida a su estabilidad y propiedades. Algunos puntos clave para reflexionar sobre los neutrones incluyen:
- Ejemplos de Neutrones: Los neutrones se encuentran junto a los protones en el núcleo de un átomo, con la excepción del hidrógeno.
- Ubicación de los Neutrones: Los neutrones están situados en el núcleo atómico, contribuyendo a la masa del átomo sin llevar una carga eléctrica.
- Descubrimiento: El físico inglés James Chadwick reveló el neutrón en 1931, identificándolo como una partícula subatómica neutral.
- Composición: Los neutrones están compuestos por tres quarks: 1 quark up y 2 quarks down.
Comprender el papel y las características de los neutrones mejora nuestra comprensión de la estructura y el comportamiento atómico.
Preguntas Frecuentes
Las partículas subatómicas que componen un átomo son los protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo del átomo, mientras que los electrones orbitan alrededor del núcleo en niveles de energía
Las partículas subatómicas que componen un átomo son los protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo, mientras que los electrones se distribuyen en la corteza. Juntos determinan las propiedades de los elementos.
¿Por qué la cantidad de protones en un átomo determina su número atómico?
La cantidad de protones en un átomo determina su número atómico porque los protones definen las propiedades químicas y la identidad del elemento. Cada elemento tiene un número único de protones, lo que lo distingue de otros elementos en la tabla periódica.
¿Qué es un isótopo y cómo se relaciona con la cantidad de neutrones en un átomo?
Un isótopo es una variante de un elemento con el mismo número atómico pero diferente cantidad de neutrones. La suma de protones y neutrones define la masa atómica. Esta diversidad isotópica influye en las propiedades químicas y físicas de los elementos.
¿Cómo influye la cantidad de electrones en la carga eléctrica de un átomo y qué son los iones?
El número de electrones en un átomo determina su carga; al ganar o perder electrones se forman iones con diferentes cargas. Por ejemplo, el cloro con 17 electrones puede ganar uno para convertirse en un ion cloruro cargado negativamente (Cl-).
¿Cuál es la diferencia en la masa entre un protón, un neutrón y un electrón, y por qué es relevante en la masa atómica de un elemento?
La diferencia de masa entre un protón, neutrón y electrón es significativa: un protón y un neutrón tienen masas similares, mientras que la del electrón es casi despreciable. Esta distinción es fundamental en la masa atómica de un elemento.
Conclusión
En resumen, los componentes fundamentales de la materia - protones, neutrones y electrones - desempeñan roles esenciales en la definición de las características y propiedades de los elementos.
Estas partículas subatómicas contribuyen a la estructura y comportamiento de los átomos, dando forma en última instancia al mundo físico que nos rodea.
Al adentrarse en la naturaleza de estas partículas y sus interacciones, se logra un entendimiento más profundo de los bloques de construcción del universo.
Si quieres conocer otros artículos parecidos a ¿Cuáles son los componentes fundamentales de la materia? puedes visitar la categoría Ciencias.

También te puede interesar: